Pagalvė yra dažnai pamirštama kryžminės infekcijos jungtis tarp pacientų. Šioje apžvalgoje tyrinėjamos įvairios šios grandies jungtys. Pateikiami įrodymai patvirtina gyvybingus infekcijos perdavimo kelius tarp pacientų, pagalvių ir supančios aplinkos. Yra nustatyta, kad padidėjusi aplinkos tarša padidina infekcijos lygį, ir kad paviršinės aplinkos valymas, paliekant pagalvės vidų užkrėstą, nėra efektyvus būdas kontroliuojant užteršimą. Svarstomas barjerinių pagalvių efektyvumas kontroliuojant užterštumą.
Įžanga
Augantis stebėjimo įrodymų kiekis palaiko intuityvią nuomonę, kad ligoninės aplinka vaidina svarbų vaidmenį hospitalinių patogenų perdavime (Gerding ir kt., 2008, Weber ir kt., 2010). Perdavimo keliai tarp pacientų (patogenų nešiotojų) buvo pastebėti kaip užkratas ir sąlytis su užterštais paviršiais tiesiogiai arba per sveikatos priežiūros darbuotojus (Chacko ir kt., 2003). Buvo įrodyta, kad pacientams, kurie guli palatose, kuriose ankstesni pacientai buvo užkrėsti įvairiais organizmais, padidėja rizika patiems užsikrėsti tais pačiais organizmais (Huang ir kt., 2006). Šią padidintą riziką sušvelnina, bet jos nepašalina, sustiprintas valymo režimas (Datta ir kt. 2011). Vienas iš nepilno rizikos panaikinimo paaiškinimų būtų tas, kad paviršiai išlieka kolonizuoti dėl neteisingo valymo protokolo laikymosi (Nseir ir kt., 2011). Šiame straipsnyje mes siūlome alternatyvą arba papildomą paaiškinimą: žymus infekcijos rezervuaras – paciento pagalvė – reguliariai išvengia valymo režimo ir iš naujo užkrečia pacientą ir aplinką daugkartiniais keliais, įskaitant tiesioginį kontaktą ir oro skleidimą aerozolio pavidalu.
Ar paciento aplinka tampa užteršta?
Oie ir kt. (2003) nustatė MRSA (Meticilinui atsparios bakterijos Staphylococcus aureus) ant rankenų 19% palatų, kuriose gulėjo MRSA turintys pacientai, lyginant su 7% palatų, kuriose gulėjo pacientai neturintys MRSA. Boyce ir kt. (1997) nustatė, kad 42% medicinos seserų užteršia savo pirštines MRSA atlikdamos darbus, kurių metu neturi tiesioginio kontakto su pacientais, bet kurių metu liečia objektus MRSA turinčių pacientų palatose. French ir kt. (2004) nustatė, kad 74% vietų, supančių pacientus, MRSA tyrimai buvo teigiami. Nustatyta, kad Clostridium difficile kolonizuoja paviršius tokius kaip grindys, viršulangiai, tualetai, patalynė, šluotos, svarstyklės ir baldai (Fekety ir kt., 1981). Kiti vyraujantys organizmai apima noro virusą ir aktino bakterijas (Weber, 2010). Nustatyta, kad čiužinių vidus yra užterštas MRSA (Ndawula ir kt., 1991). French ir kt. (2004) ėmė mėginius iš aplinkos, supančios pacientus su teigiamu MRSA ir nustatė, kad 74% mėginių tyrimai buvo teigiami dėl MRSA.
Ar tai apima ir Pagalvę?
Pagalvė yra idealus patogenų rezervuaras dėl daugelio priežasčių. Paprastai ligoninės pagalvės vidus yra užpildytas poliesterio pluoštu arba elastiniu putų poliuretanu. Esant palankioms sąlygoms, bet kuri iš šių terpių suteikia idealią gyvenamąją aplinką mikroorganizmų egzistavimui ir dauginimuisi (Woodcock ir kt., 2006). Užpildymo medžiagos porėtumas suteikia didelį paviršiaus plotą kolonizacijai, o didelis kapiliarumas – drėgmės sulaikymui. Pacientas taip pat sudaro palankias sąlygas: ideali temperatūra inkubacijai, drėgmė, mityba kūno skysčiais ir detritais bei inokuliacija per paciento nosį, burną, ausis ir plaukus.
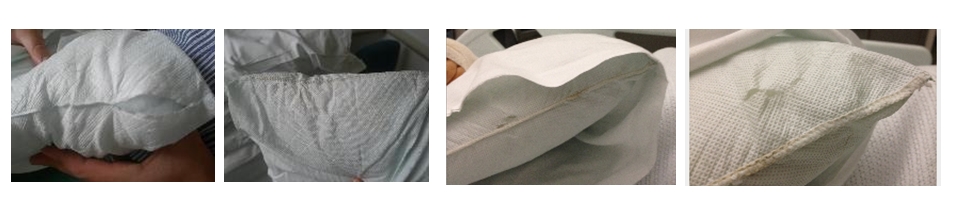
Lange ir kt. (2014) nustatė, kad 38% ligoninių pagalvių buvo kolonizuotos MRSA ir koliforminėmis bakterijomis ir padarė išvadą, kad būtų verta panagrinėti vienkartinių pagalvių galimybę. Shik ir kt. (2014) perpjovė iš esmės skysčiui atsparias (siūlėmis susiūtas) pagalves nudegimų skyriuje ir nustatė, kad dauguma buvo akivaizdžiai užterštos kūno skysčiais. Mottar ir kt. (2006) pastebėjo žymų pagalvių svorio neatitikimą nudegimų centre. Tyrimas atskleidė, kad siūlės buvo pratekėjimo šaltinis, o daugybiniai patogenai buvo izoliuoti nuo pagalvių vidaus, kuris koreliavo su pacientų infekcijomis. Lippmann ir kt. (2014) ieškojo infekcijos rezervuarų, kad paaiškintų didžiulį Klebsiella pneumoniae carbapenemase (KPC) proveržį Vokietijoje. Jie nustatė, kad naudojamos pagalvės buvo užterštos iš vidaus ir išliko tokios mažiausiai 6 mėnesius.
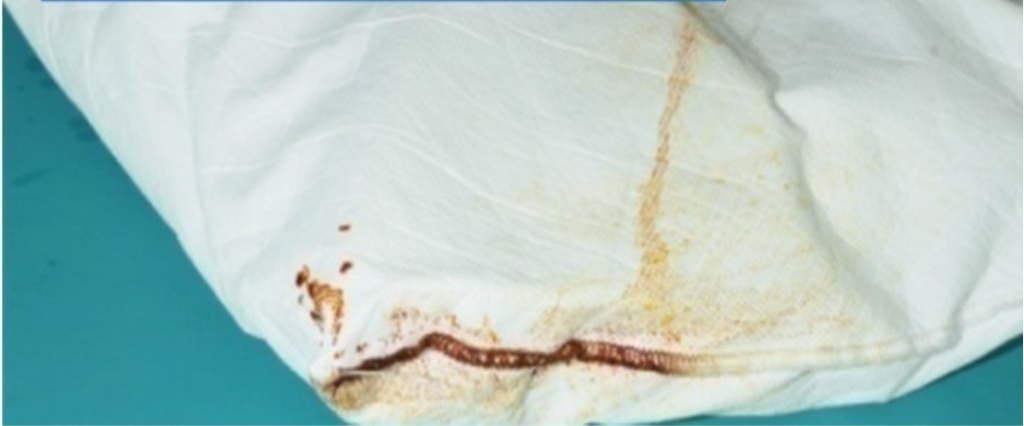
Įprasta praktika įvilkti pagalvę į vandeniui atsparų užvalkalą problemos neišsprendžia. Kadangi pagalvė būtinai turi susispausti ir išsipūsti, kad atliktų savo, kaip pagalvės, funkciją prisitaikyti prie paciento galvos (ar kitos kūno dalies), todėl 2 litrai oro turi įeiti ir išeiti iš pagalvės per kelias sekundes, kai ant pagalvės atitinkamai yra uždedamas ar nuimamas krūvis. Paprastos vandeniui atsparios pagalvės atveju, šis oras pasirinks kelią per atvartą, o jei užvalkalas yra susiūtas, tai per užvalkalo siūlės dygsnių skylutes. Ypatingai probleminis yra antrasis atvejis. Didelės infekcijų koncentracijos gali patekti į pagalvės vidų tiesiog per susiūtą siūlę (Dewhurst ir kt. 2012). Čia jos išlieka ir inkubuoja. To pasekmėje, iš pagalvės išstumiamas užterštas oras yra staigiai išspaudžiamas per mažas siūlių skylutes, sukurdamas aerozolį, kuris gali išlikti supančiame ore daug valandų ir kuris geba persikolonizuoti ne tik esančiame ar vėlesniame paciente, bet ir paciento aplinkoje (Kalogerakis, 2005).
Įrodyta, kad užpildo medžiagos minkštuose balduose suteikia pakankamą maitinimą bakterijų augimui (Jenkins ir kt., 2008). Polimerinės medžiagos naudojamos užpildui suteikia pakankamą anglies ir azoto šaltinį, kurio reikia augimui (Jeinkins ir kt., 2005). Woodcock ir kt. (2006) taip pat nustatė, kad 47 rūšys grybų, įskaitant Aspergillus fumigatus, Aureobasidium pullulans,Rhodotorula mucilaginosa buvo būdingos pagalvėse.
Ar yra gyvybingas perdavimo kelias?
Jau 1979 metais (Reiss-Levy ir kt., 1979) diskutavo, kad pagalvės platina MRSA. Sherburn ir kt. (2005) nustatė bakterijų išsiskyrimą iš čiužinių per orą, kuomet ant jų uždedamas svoris. Judesys ant panaudotų vaikiškų lovelių čiužinių, imituojant kūdikio galvos judesius, žymiai padidino natūraliai įgytų bakterijų išsiskyrimą per orą iš putų poliuretano (bendri skaičiavimo duomenys, P = 0.008; Staphylococcus aureus, P = 0,004) ar iš polivinilchlorido apdangalų (bendri skaičiavimo duomenys, P = 0.001) (Sherburn ir kt., 2005). Jie nustatė, kad bakterijų lygis ore yra proporcingas pagalvių viduje inokuliuotų bakterijų populiacijų lygiui.
Shiomori ir kt. (2002) apskaičiavo MRSA kiekius ore prieš, per ir po lovos klojimo. Oro mėginiai buvo imami naudojant Andersen oro mėginių ėmiklį 13 palatų su stacionariais ligoniais, turinčiais MRSA infekciją ar kolonizaciją. Paviršių mėginių ėmimas, įskaitant grindis ir paklodes, buvo atliekamas antspaudavimo metodu. MRSA kolonizacijos lygis buvo žymiai didesnis po lovos klojimo, o MRSA buvo nustatytos ant daugelio paviršių. Rezultatai leidžia teigti, kad MRSA cirkuliuoja ore, ypač po judėjimo.
Boore ir kt. (2014) atliko plataus masto dalelių pakartotinės suspensijos eksperimentus aplinkos kameroje, kur savanoriai atliko numatytą judėjimo veiksmą ant dirbtinai infekuoto čiužinio. Buvo nustatyta, kad žmogaus judesiai lovoje, tokie kaip apsivertimas nuo šono ant nugaros, pakartotinai suspendavo nusėdusias daleles, dėl ko padidėdavo ore esančių dalelių koncentracija. Pakartotinė suspensija padidėdavo esant judesių intensyvumui, apibūdinamam kaip paviršiaus vibravimas, ir sumažėdavo esant pasikartojantiems judesiams. Įkvėpimas vyravo nuo 102 iki 104 įkvėptų dalelių iš milijono pakartotinai suspenduotų, tai parodo, kad didelę į orą išleistų dalelių frakciją galima įkvėpti miego metu.
Kai nuo pagalvės nuimamas svoris, oras įeina į vidų. Kai užkrėsto paciento burna ir nosis yra labai arti, yra didelė tikimybė, kad ir oras bus užterštas. Kaip aptarta aukščiau, pagalvė suteikia drėgną, šiltą ir kupiną maisto aplinką mikroorganizmų inkubacijai ir išgyvenimui. To pasekmėje, kai pagalvė suspaudžiama, iš jos vidaus yra pašalinamas užterštų garų lašelių aerozolis, dažniausiai išeinantis per pagalvių siūlių skylutes. Tai suteikia priemones vėl kolonizuoti aplinką nenustatytam laikotarpiui, kas kelia didelį nerimą dėl būsimų pacientų, kurių veidai gali būti labai arti pagalvės.
Ar aplinkos užterštumas lemia padidėjusią infekcijos riziką?
Labiausiai paplitę hospitaliniai patogenai gali išgyventi ar išlikti ant įvairių paviršių keletą mėnesių ir dėl to gali būti nuolatinis perdavimo šaltinis, jei neatliekama reguliari prevencinė paviršių dezinfekcija. (Rutala ir kt., 2011). Buvo atliktas patikrinimas (Rutala ir kt., 2006), kurio metu nustatyta, kad dauguma gramteigiamų ir daug gramneigiamų bakterijų išgyvena daugelį mėnesių ant kieto sauso paviršiaus. Daugybės perspektyvių tyrimų metu buvo nustatytas ryšys tarp pacientų, užsikrėtusių konkrečiais organizmais, aplinkos kolonizacijos ir būsimų pacientų rizikos užsikrėsti tuo pačiu organizmu.
Tsakiridou ir kt. (2014A) perspektyviai tyrinėjo pneumonijos dažnį dėl Acinetobacter baumannii intensyvios priežiūros skyriuje ir nustatė, kad ankstesnio paciento, užsikrėtusio Acinetobacter baumannii, buvimas padidino riziką 12 kartų (95% Cl 2.3-19,5). Huang ir kt. (2006) nustatė, kad įėjimas į palatą, kurioje anksčiau buvo pacientas, kuriam nustatytas teigiamas MRSA arba teigiamas VRE (Vankomicinui atsparūs enterokokai), padidino tikimybę įgyti MRSA arba VRE. Drees ir kt. (2008) nustatė, kad ankstesnis palatos užteršimas, matuojamas aplinkos kultūromis ar ankstesnio VRE-kolonizuoto paciento buvimu, prognozuoja VRE įgijimą. Faktoriai, padidinantys infekcijos riziką, buvo VRE-kolonizuotas ankstesnis palatos pacientas (HR, 3.1; 95% Cl, 1.6-5.8), bet kokie VRE-kolonizuoti palatų pacientai per ankstesnes 2 savaites (HR, 2.5; 95% Cl 1.3-4.8), ir ankstesni teigiami palatos kultūrų rezultatai (HR, 3.4; 95% Cl, 1.2-9.6). Nseir ir kt. (2011) nustatė, kad nepriklausomi rizikos faktoriai įgyti A. baumannii intensyvios priežiūros skyriuje buvo ankstesnis pacientas su A. baumannii bakterija (OR 4.2, 95% Cl 2-8.8, p<0.001).
2013 metais (Otter ir kt., 2013) buvo keliama hipotezė, kad užteršti paviršiai prisideda prie ligoninės patogenų perdavimo. Buvo atlikta šios temos apžvalga, įskaitant tyrimus modeliuojant perdavimo kelius, mikrobiologinius tyrimus, epidemiologinius stebėjimo tyrimus, intervencinius tyrimus ir protrūkio ataskaitas. Apžvalga leido daryti išvadas, kad užteršti paviršiai prisideda prie perdavimo.
Ar valymas yra efektyvus kontrolės mechanizmas?
Dancer ir kt. (2009), įdiegė sustiprinto valymo režimą dviejose palatose 6 mėnesiams su perspektyva jį palikti. Pagerinto valymo rezultatas buvo 33% sumažėję kolonijų skaičiai ant rankomis liečiamų paviršių ir 27% sumažėjusios MRSA infekcijos. Mikrobų kultūros ir genotipai teigiamai atitiko MRSA ryšį tarp liečiamų paviršių ir pacientų.

Datta ir kt. (2007) nustatė, kad sustiprintas intensyvios priežiūros skyriaus valymas sumažino MRSA ir VRE perdavimą ir gali sumažinti MRSA įgijimą dėl ankstesnio palatos paciento su teigiamu MRSA. MRSA ir VBE įgijimas sumažėjo nuo 3.0% iki 1.5% MRSA ir nuo 3.0% iki 2.2% VRE (P < .001 abiem). Pacientai, esantys tose palatose, kuriose anksčiau buvo MRSA nešiotojai turėjo padidintą įgijimo riziką baziniame lygmenyje (3.9% vs 2.9, P = .03), bet ne intervencijos periodu (1.5% vs 1.5%, P = .79). Priešingai, pacientai tose palatose, kurias anksčiau buvo užėmę VRE nešiotojai, turėjo padidintą įgijimo riziką baziniame lygmenyje (4.5% vs 2.8%, P = .001) ir intervencijos periodais (3.5% vs 2.0%, P < .001).
Tačiau Andrada ir kt. (2000) nustatė, kad padidintas valymo lygis jų aplinkoje nesumažino aplinkos kolonizacijos, o kito tyrimo metu (Nseir ir kt. 2011) buvo nustatyta, kad nepaisant atkaklaus galutinio valymo režimo, tikimybė užsikrėsti organizmais žymiai padidėjo dėl to, kad ankstesnis pacientas buvo užsikrėtęs tuo organizmu. Jie padarė išvadą, kad intensyvios priežiūros skyriaus palatų valymas turbūt buvo neefektyvus naikinant MDR P. aeruginosa ir A. baumannii bakterijas, darant prielaidą, kad atitikimas valymo protokolui nebuvo optimalus.
Alternatyvus paaiškinimas yra tas, kad nepaisant valymo, tiesioginė aplinka yra nedelsiant pakartotinai kolonizuojama nuo iš pagalvės prasiveržiančio užteršto aerozolio.
„Barjerinių“ pagalvių efektyvumas
Pastaruoju metu buvo pristatyta nauja medicinos priemonių kategorija: barjerinė antialerginė pagalvė [CE ženklas IE/CAO1/M/GM/0889]. Kol kas vienintelis ligoninėms prieinamas pavyzdys yra Pneumapure pagalvė (Gabriel Scientific, Dublinas). Ši pagalvė skiriasi nuo standartinių uždarų pagalvių tuo, kad siūlės yra suvirinamos aukštu dažniu ir sudaro sandarumą, priešingai nei susiūtos. Susiuvimo skylučių nebuvimas apsaugo nuo užteršto oro patekimo per siūles. Vietoj to, oras įeina ir išeina iš pagalvės per vandeniui atsparų mikrobiologinį filtrą, kuris, kaip nustatyta testais, apsaugo nuo 25 nm dydžio bakterijų, grybų ir virusų patekimo (Airmid Laboratorijų ataskaita, 2013). Pagalvės užvalkalas yra valomas ir dezinfekuojamas po kiekvieno paciento pagal standartinius čiužinių valymo protokolus.
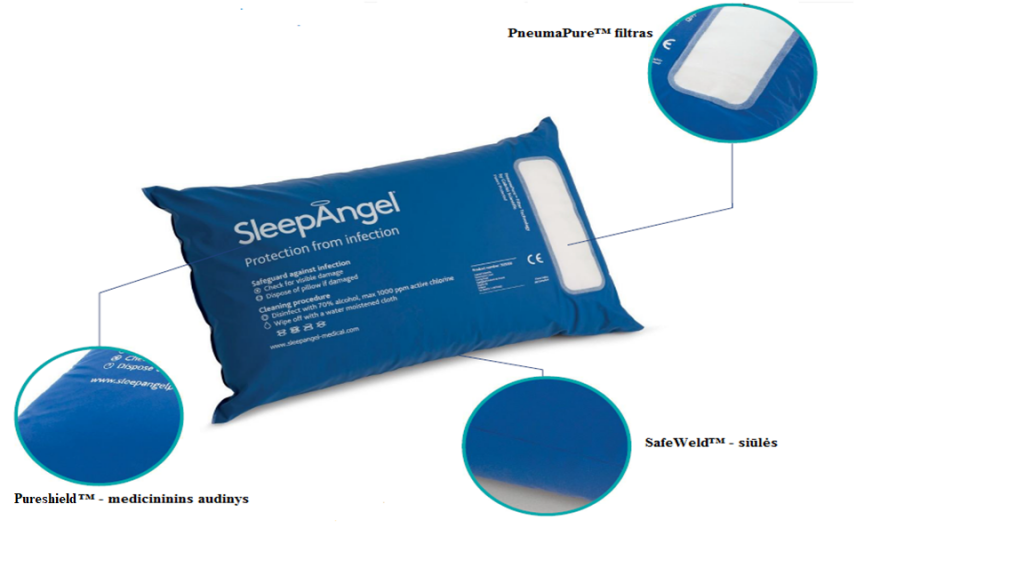
Tiriamojoje ligoninės, turinčios daug centrų, aplinkoje (Dewhurst ir kt., 2012) 100 naujų Pneumapure pagalvių buvo lyginamos su 100 naujų paprastai uždarų (susiūtomis siūlėmis) pagalvių. Po 3 mėnesių naudojimo buvo imami pagalvių vidaus mėginiai. Šešiasdešimt procentų standartinių pagalvių buvo užterštos iš vidaus tuo tarpu 0% Pneumapure pagalvių buvo užterštos. Papildomai šio tyrimo metu buvo nustatyta, kad ten, kur pagalvės buvo vizualiai sugadintos, purvinos ir netinkamos naudoti, nebuvo jokios sistemos, kuri pašalintų tas pagalves iš naudojimo. Šie duomenys lėmė patikimą Pneumapure pagalvės įdiegimą Liverpulio ir Broadgryno NHS treste, kartu su reguliariu pagalvių audito režimu ir dėl to sumažėjusiomis MRSA ir CDiff infekcijomis.
Išvada
Užkrėsta pagalvė turi šį tą bendro su užkrėstu žmogumi, kalbant apie galimybę skleisti infekciją. Žmogus kosėja ir čiaudi generuodamas periodinį užterštų medžiagų aerozolį į supančią aplinką. Standartinė pagalvė su užvalkalu, susiūta siūlėmis, kaip jau aptarėme, atlieka labai panašų veiksmą: maždaug 2 litrai drėgno mikroorganizmais užteršto oro pernešamo lašelių suspensijose yra išskleidžiama į aplinką kiekvieną kartą, kai pacientas padeda galvą ant pagalvės. Jie turi gebėjimą iš naujo kolonizuotis artimoje aplinkoje paneigdami bet kokio valymo režimo efektyvumą. Pagalvės, kaip ir žmogus, cirkuliuoja po ligoninę ar net tarp ligoninių (Turk ir kt., 2017).
McDonald ir Arduino (2013) pateikė įrodymų hierarchiją dėl priemonių įdiegimo kontroliuoti infekcijas, pradedant nuo (I) laboratorinių patvirtinimų, tęsiant (II) naudojamos biologinės naštos įrodymu, (III) įrodymu, kad sumažinimas yra kliniškai reikšmingas, (IV) sumažinto patogenų perdavimo įrodymu, ir baigdami (V) sumažintų infekcijų įrodymu. Žinoma, yra sudėtinga naudotis šia hierarchija: daugybė pacientų ir praktikos veiksnių riboja tarpusavio ryšį tarp aplinkos mikroorganizmų sumažinimo ir perdavimo nutraukimo. Dar sudėtingesnis yra ryšys tarp infekcijų ir aplinkos mikroorganizmų mažinimo. Tačiau įdiegus barjerines pagalves, kaip infekcijos nutraukimo metodą, yra didelė perspektyva pereiti prie V šių kopėčių lygio.
Laboratoriniai patvirtinimai rodo, kad barjerinės pagalvės yra nepralaidžios patogenams, tuo tarpu standartinės pagalves sparčiai kolonizuoja ilgaamžiai organizmai. Mėginiai iš naudojamų pagalvių parodo mikroorganizmus standartinių pagalvių viduje, ko visiškai nėra barjerinėse pagalvėse. Žinoma, kad aplinka yra užteršiama per pagalvių išskleidžiamą orą aerozolio pavidalu, ir yra žinoma, kad padidėjęs aplinkos užterštumas padidina infekcijos perdavimą bei dažnį.
Užkrėstos pagalvės yra ryškus infekcijos vektorius, o CE paženklintų, patvirtintų barjerinių pagalvių įdiegimas kartu su audito protokolu, kurio metu svarstoma, ar pagalvės ir jų tarnavimo sąlygos yra tinkamos, yra paprasta, nebrangi ir protinga priemonė.


Parašė: Dr. Duncan Bain, David Woolfson
Redagavo: Dr. Uyen Nguyen
Recenzijavo: Darrel Hicks, Dr. Michael Ackerman
Pagalvė:
Pamirštas patogenų nešiotojas
Šaltiniai:
https://infectioncontrol.tips/2017/05/16/pillows-the-forgotten-fomite/
Nuorodos:
Airmid Health Group Report ASCR092029 Pneumapure pillow, Airmid Health Group March 2013
Andrade D, Angerami EL, Padovani CR. Microbiological conditions of hospital beds before and after terminal cleaning
Boor BE, Spilak MP, Corsi RL, Novoselac A. Characterizing particle resuspension from mattresses: chamber study.
Indoor Air. 2014 Jul 31. doi: 10.1111/ina.12148. [Epub ahead of print]
Boyce JM, Potter-Bynoe G, Chenevert C, King T. Environmental contamination due to methicillin-resistant Staphylococcus aureus: possible infection control implications. Infect Control Hosp Epidemiol. 1997 Sep;18(9):622-7.
Chacko L, Jose S, Isac A, Bhat KG. Survival of nosocomial bacteria on hospital fabrics. Indian J Med Microbiol. 2003 Oct-Dec;21(4):291.
Dancer SJ, White LF, Lamb J, Girvan EK, Robertson C. Measuring the effect of enhanced cleaning in a UK hospital: a prospective cross-over study. BMC Med. 2009 Jun 8;7:28. doi: 10.1186/1741-7015-7-28.
Datta R1, Platt R, Yokoe DS, Huang SS. Environmental cleaning intervention and risk of acquiring multidrug-resistant organisms from prior room occupants. Arch Intern Med. 2011 Mar 28;171(6):491-4. doi: 10.1001/archinternmed.2011.64.
Dewhurts et al The Pillow is a vector for infection, Proceedings IPS 2012
Drees M1, Snydman DR, Schmid CH, Barefoot L, Hansjosten K, Vue PM, Cronin M, Nasraway SA, Golan Y. Prior environmental contamination increases the risk of acquisition of vancomycin-resistant enterococci. Clin Infect Dis. 2008 Mar 1;46(5):678-85. doi: 10.1086/527394.
Fekety R, Kim KH, Brown D, Batts DH, Cudmore M, Silva J Jr. Epidemiology of antibiotic-associated colitis; isolation of Clostridium difficile from the hospital environment. Am J Med. 1981 Apr;70(4):906-8.
French GL1, Otter JA, Shannon KP, Adams NM, Watling D, Parks MJ. Tackling contamination of the hospital environment by methicillin-resistant Staphylococcus aureus (MRSA): a comparison between conventional terminal cleaning and hydrogen peroxide vapour decontamination. J Hosp Infect. 2004 May;57(1):31-7.
Gerding DN1, Muto CA, Owens RC Jr. Measures to control and prevent Clostridium difficile infection. Clin Infect Dis. 2008 Jan 15;46 Suppl 1:S43-9. doi: 10.1086/521861.
Huang SS1, Yokoe DS, Hinrichsen VL, Spurchise LS, Datta R, Miroshnik I, Platt R. Impact of routine intensive care unit surveillance cultures and resultant barrier precautions on hospital-wide methicillin-resistant Staphylococcus aureus bacteremia. Clin Infect Dis. 2006 Oct 15;43(8):971-8. Epub 2006 Sep 14.
Huang SS, Datta R, Platt R. Risk of acquiring antibiotic-resistant bacteria from prior room occupants. Arch Intern Med. 2006 Oct 9;166(18):1945-51.
Jenkins, R. O., & Sherburn, R. E. (2008). Used cot mattresses as potential reservoirs of bacterial infection: nutrient availability within polyurethane foam. Journal of applied microbiology, 104(2), 526-533.
Jenkins RO, Sherburn RE. Growth and survival of bacteria implicated in sudden infant death syndrome on cot mattress materials. J Appl Microbiol. 2005;99(3):573-9.
Kalogerakis, N.,Indoor air quality – bioaerosol measurements in domestic and office premises. Journal of Aerosol Science, 2005. 36(5-6): p. 751-761.
Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate surfaces? A systematic review. BMC Infect Dis. 2006 Aug 16;6:130.
Lange V American Reusable Hospital Pillows – A Reservoir for Hospital Acquired Pathogens: The Importance of Adequate DecontaminationJournal of Infection Control Volume 42, Issue 6, Supplement, Pages S34–S35, June 2014
Lippmann N Lübbert C, Kaiser T, Kaisers UX, Rodloff AC. Clinical epidemiology of Klebsiella pneumoniae
carbapenemases Lancet Infect Dis. 2014 Apr;14(4):271-2. doi: 10.1016/S1473-3099(14)70705-4.
McDonald LC, Arduino M. Editorial commentary: climbing the evidentiary hierarchy for environmental infection control. Clin Infect Dis. 2013 Jan;56(1):36-9. doi: 10.1093/cid/cis845. Epub 2012 Oct 5.
Mottar, R., et al. “Pillow talk: examining pillow cores in a regional burn center.” American Journal of Infection Control 34.5 (2006): E107-E108.
Ndawula EM, Brown L. Mattresses as reservoirs of epidemic methicillin-resistant Staphylococcus aureus. Lancet. 1991 Feb 23;337(8739):488.
Nseir S, Blazejewski C, Lubret R, Wallet F, Courcol R, Durocher A. Risk of acquiring multidrug-resistant Gram-negative bacilli from prior room occupants in the intensive care unit. Clin Microbiol Infect. 2011 Aug;17(8):1201-8. doi: 10.1111/j.1469-0691.2010.03420.x. Epub 2010 Dec 13.
Oie S, Hosokawa I, Kamiya A. Contamination of room door handles by methicillin-sensitive/methicillin-resistant Staphylococcus aureus. J Hosp Infect. 2002 Jun;51(2):140-3.
Otter JA, Yezli S, Salkeld JA, French GL. Evidence that contaminated surfaces contribute to the transmission of hospital pathogens and an overview of strategies to address contaminated surfaces in hospital settings. Am J Infect Control. 2013 May;41(5 Suppl):S6-11. doi: 10.1016/j.ajic.2012.12.004.
Otter JA, Yezli S, French GL. The role played by contaminated surfaces in the transmission of nosocomial pathogens. Infect Control Hosp Epidemiol. 2011 Jul;32(7):687-99. doi: 10.1086/660363
Reiss-Levy E, McAllister E Pillows spread methicillin-resistant staphylococci. Med J Aust. 1979 Feb 10;1(3):92.
Rutala WA, Weber DJ. Surface disinfection: should we do it? J Hosp Infect. 2001 Aug;48 Suppl A:S64-8.
Sherburn RE, Jenkins RO. Cot mattresses as reservoirs of potentially harmful bacteria and the sudden infant death syndrome. FEMS Immunol Med Microbiol. 2004 Sep 1;42(1):76-84.
Sherburn RE, Jenkins RO. Aerial release of bacteria from cot mattress materials and the sudden infant death syndrome. J Appl Microbiol. 2005;98(2):293-8.
Shik N.F., , Ford S., Thompson R., , Pena M., , Luchi M., The Heat Is On: Control of Community-Acquired MRSA in a Burn Center American Journal of Infection Control June 2006Volume 34, Issue 5, Page E100, ;
Shiomori T, Miyamoto H, Makishima K, Yoshida M, Fujiyoshi T, Udaka T, Inaba T, Hiraki N. Evaluation of bedmaking-related airborne and surface methicillin-resistant Staphylococcus aureus contamination. J Hosp Infect. 2002 Jan;50(1):30-5
Tsakiridou E, Makris D, Daniil Z, Manoulakas E, Chatzipantazi V, Vlachos O, Xidopoulos G, Charalampidou O, Zakynthinos E. Acinetobacter baumannii infection in prior ICU bed occupants is an independent risk factor for subsequent cases of ventilator-associated pneumonia. Biomed Res Int. 2014;2014:193516. doi: 10.1155/2014/193516.
Epub 2014 Jul 2.
Turk S, Christersson J, Rööp T Comparison of bacterial loads of two types of hospital pillows: Perspectives of improving hospital hygiene standards. Canadian Journal of Infection Control (in press) 2017
Weber D, Rutala W, Miller M, Huslage K, Sickbert-Bennet E. Role of hospital surfaces in the transmission of emerging healthcare-associated pathogens; norovirus, Clostridium difficile, and Acinetobacter species. American Journal of Infection Control, 2010 Jun; 35 (5 Suppl 1) S25-33.
William A. Rutala, PhD, MPH; David J. Weber, MD, MPH Are Room Decontamination Units Needed to Prevent Transmission of Environmental Pathogens? Infection Control and Hospital Epidemiology, Vol. 32, No. 8 (August 2011), pp. 743-747
Woodcock, AA., Steel, N., Moore, CB., et al. Fungal contamination of bedding North West Lung Centre, Wythenshawe Hospital and University of Manchester, Manchester, UK. Allergy, 2006 Jan;61(1):140-2
Youngster I, Berkovitch M, Heyman E, Lazarovitch Z, Goldman M. The stethoscope as a vector of infectious diseases in the paediatric division. Acta Paediatr. 2008 Sep;97(9):1253-5. doi: 10.1111/j.1651-2227.2008.00906.x. Epub 2008 Jun 12.